- В лабораторії [ правити | правити код ]
- У промисловості [ правити | правити код ]
- Отримання пиролизом [ правити | правити код ]
- Регенеративний піроліз [ правити | правити код ]
- Окислювальний піроліз [ правити | правити код ]
- Гомогенний піроліз [ правити | правити код ]
- Піроліз в струмені низькотемпературної плазми [ правити | правити код ]
- Карбідний метод [ правити | правити код ]
open wikipedia design.
ацетилен 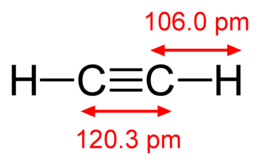
 загальні систематичне
загальні систематичне
найменування Етін Традиційні назви Ацетилен Хім. формула C2H2 Рац. формула HCCH Фізичні властивості молярна маса 26,038 [1] г / моль щільність 1,0896 г / л енергія іонізації 11,4 ± 0,1 еВ [2] термічні властивості Т. плав. -80,8 тисяча двісті сімдесят сім мм Hg ° C -119 ± 1 ° F [2] Т. кип. -83,6 ° C Т. свспл. 335 ° C Пр. взрв. 2,5 ± 0,1 об.% [2] Потрійна точка -80,55 Кр. крапка 35,2 ° С; 6,4 МПа Мовляв. теплоємність. 44,036 Дж / (моль · К) ентальпія освіти +226,88 кДж / моль ентальпія згоряння -1302 кДж / моль Тиск пара 44,2 ± 0,1 атм [2] Хімічні властивості pKa 25 розчинність в воді 10018 мл / 100 мл розчинність в етанолі 60018 мл / 100 мл Структура гібридизація sp Класифікація Реєстр. номер CAS 74-86-2 PubChem 6326 Реєстр. номер EINECS 200-816-9 SMILES InChI RTECS AO9600000 ChEBI 27518 номер ООН +1001 ChemSpider 6086 Безпека токсичність  Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Ацетилен (по ІЮПАК - Етін) - органічна сполука , неграничний вуглеводень C2H2. має потрійну зв'язок між атомами вуглецю , Належить до класу алкинов . при нормальних умовах - безбарвний, дуже горючий газ .
В лабораторії [ правити | правити код ]
У лабораторії, а також в газозварювальному обладнанні, ацетилен отримують дією води на карбід кальцію [3] ( Ф. Велер , 1862 рік ) [4] :
C a C 2 + 2 H 2 O → C a (OH) 2 + C 2 H 2 ↑ {\ displaystyle {\ mathsf {CaC_ {2} + 2H_ {2} O \ rightarrow Ca (OH) _ {2} + C_ {2} H_ {2} \ uparrow}}}
а також при дегидрировании двох молекул метану при температурі понад 1400 ° C:
2 C H 4 → C 2 H 2 + 3 H 2 {\ displaystyle {\ mathsf {2CH_ {4} \ rightarrow C_ {2} H_ {2} + 3H_ {2}}}}
У промисловості [ правити | правити код ]
У промисловості ацетилен отримують гідролізом карбіду кальцію та пиролизом вуглеводневої сировини - метану або пропану з бутаном . В останньому випадку ацетилен отримують спільно з етиленом і домішками інших вуглеводнів. Карбідний метод дозволяє отримувати дуже чистий ацетилен, але вимагає високої витрати електроенергії. Піроліз істотно менше енерговитрат, тому що для нагріву реактора використовується згоряння того ж робочого газу в зовнішньому контурі, але в газовому потоці продуктів концентрація самого ацетилену низька. Виділення і концентрування індивідуального ацетилену в такому випадку представляє складну задачу. Економічні оцінки обох методів численні, але суперечливі [5] [:Стор. 274].
Отримання пиролизом [ правити | правити код ]
електрокрекінг [ правити | правити код ]
Метан перетворюють в ацетилен і водень в електродугових печах (температура 2000-3000 ° С, напруга між електродами 1000 В). Метан при цьому розігрівається до 1600 ° С. Витрата електроенергії становить близько 13000 кВт • год на 1 тонну ацетилену, що відносно багато (приблизно дорівнює енергії, що витрачається по КАРБІДНИЙ методу) і тому є недоліком процесу. Вихід ацетилену становить 50%.
Регенеративний піроліз [ правити | правити код ]
Інша назва - Вульф-процес. Спочатку розігрівають насадку печі шляхом спалювання метану при 1350-1400 ° С. Далі через розігріту насадку пропускають метан. Час перебування метану в зоні реакції дуже мало і складає долі секунди. Процес реалізований в промисловості, але економічно виявився не таким перспективним, як вважалося на стадії проектування.
Окислювальний піроліз [ правити | правити код ]
Метан змішують з киснем . Частина сировини спалюють, а що утворюється тепло витрачають на нагрівання залишку сировини до 1600 ° С. Вихід ацетилену становить 30-32%. Метод має переваги - безперервний характер процесу і низькі енерговитрати. Крім того, з ацетиленом утворюється ще і синтез-газ. Цей процес (Закса-процес або BASF-процес) отримав найбільш широке впровадження.
Гомогенний піроліз [ правити | правити код ]
Є різновидом окисного піролізу. Частина сировини спалюють з киснем в топці печі, газ нагрівається до 2000 ° С. Потім в середню частину печі вводять залишок сировини, попередньо нагрітий до 600 ° С. Утворюється ацетилен. Метод характеризується більшою безпекою і надійністю роботи печі.
Піроліз в струмені низькотемпературної плазми [ правити | правити код ]
Процес розробляється з 1970-х років, але, незважаючи на перспективність, поки не впроваджений в промисловості. Сутність процесу полягає в нагріванні метану іонізованим газом. Перевага методу полягає у відносно низьких енерговитратах (5000-7000 кВт • год) і високих виходах ацетилену (87% в аргонової плазмі і 73% у водневій).
Карбідний метод [ правити | правити код ]
Цей спосіб відомий з XIX століття, але не втратив свого значення до теперішнього часу. Спочатку одержують карбід кальцію, сплавляючи оксид кальцію і кокс в електропечах при 2500-3000 ° С:
C a O + 3 C → C a C 2 + C O ↑ {\ displaystyle {\ mathsf {CaO + 3C \ rightarrow CaC_ {2} + CO \ uparrow}}}
вапно отримують з карбонату кальцію :
C a C O 3 → C a O + C O 2 ↑ {\ displaystyle {\ mathsf {CaCO_ {3} \ rightarrow CaO + CO_ {2} \ uparrow}}}
Далі карбід кальцію обробляють водою:
C a C 2 + 2 H 2 O → C 2 H 2 + C a (OH) 2 {\ displaystyle {\ mathsf {CaC_ {2} + 2H_ {2} O \ rightarrow C_ {2} H_ {2} + Ca (OH) _ {2}}}}
Одержуваний ацетилен має високу ступінь чистоти 99,9%. Основним недоліком процесу є висока витрата електроенергії: 10000-11000 кВт • год на 1 тонну ацетилену.
при нормальних умовах - безбарвний газ , легше повітря . Чистий 100% ацетилен не володіє запахом. Технічний ацетилен зберігається в балонах з пористим наповнювачем, просоченим ацетоном (тому що чистий ацетилен при стисненні вибухає), і може містити інші домішки, які надають йому різкий запах [6] . малорастворим в воді , Добре розчиняється в ацетоні . Температура кипіння -83,6 ° C [7] . Потрійна точка -80,55 ° C при тиску 961,5 мм рт. ст., критична точка 35,18 ° C при тиску 61,1 атм [8] .
Ацетилен вимагає великої обережності при поводженні. Може вибухати від удару, при нагріванні до 500 ° C або при стисненні вище 0,2 МПа [4] при кімнатній температурі. Струмінь ацетилену, випущена на відкритий повітря , Може спалахнути від найменшої іскри, в тому числі від розряду статичної електрики з пальця руки. Для зберігання ацетилену використовуються спеціальні балони, заповнені пористим матеріалом, просоченим ацетоном [9] .
Ацетилен виявлений на урані і Нептуні .
- Для ацетилену (Етін) характерні реакції приєднання:
HC ≡ CH + Cl 2 ⟶ ClCH = CHCl {\ displaystyle {\ ce {HC # CH + Cl_2 -> ClCH = CHCl}}}
Ацетилен з водою, в присутності солей ртуті та інших каталізаторів , утворює оцтовий альдегід ( реакція Кучерова ). В силу наявності потрійний зв'язку, молекула високоенергетичних і володіє великою питомою теплотою згоряння - 14000 ккал / м³ (50,4 МДж / кг). При згорянні в кисні температура полум'я досягає 3150 ° C. ацетилен може полімеризуватися в бензол та інші органічні сполуки ( поліацетилен , вінілацетилен ). Для полімеризації в бензол необхідний графіт і температура в ~ 500 ° C. У присутності каталізаторів, наприклад, трікарбоніл (трифенілфосфін) нікелю, температуру реакції циклізації можна знизити до 60-70 ° C.
Крім того, атоми водню ацетилену відносно легко відщеплюються у вигляді протонів , Тобто він проявляє кислотні властивості. Так, ацетилен витісняє метан з ефірного розчину метілмагнійброміда (утворюється містить ацетіленід-іон розчин), утворює нерозчинні вибухові опади з солями срібла і одновалентной міді .
Основні хімічні реакції ацетилену (реакції приєднання, зведена таблиця 1.):
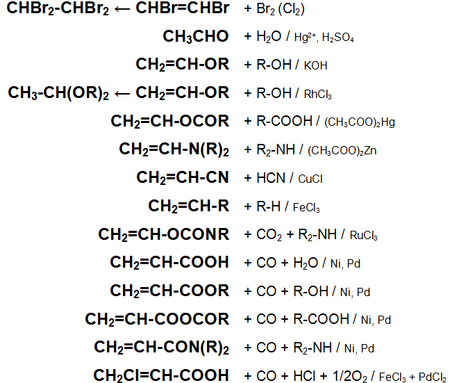
Основні хімічні реакції ацетилену (реакції приєднання, димеризации, полімеризації, цікломерізаціі, зведена таблиця 2.):
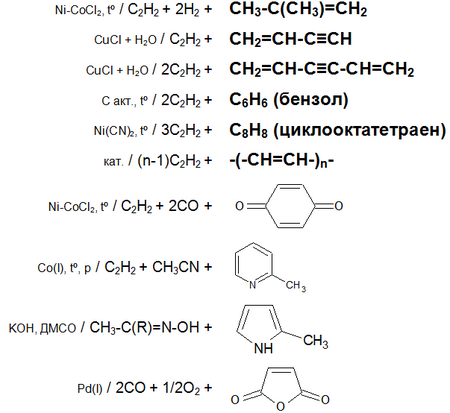
ацетилен знебарвлює бромную воду і розчин перманганату калію .
Реагує з аміачними розчинами солей Cu (I) і Ag (I) з утворенням малорозчинних, вибухових ацетіленід - ця реакція використовується для якісного визначення ацетилену і його відмінності від алкенів (які теж обесцвечивают бромную воду і розчин перманганату калію).
відкрито в 1836 році Е. Деві , Синтезований з вугілля і водню (Дугового розряд між двома вугільними електродами в атмосфері водню) М. Бертло ( 1862 рік ).
Ацетилен використовують:
- для газового зварювання і різання металів ,
- як джерело дуже яскравого, білого світла в автономних світильниках, де він виходить реакцією карбіду кальцію і води (див. карбідна лампа ),
- у виробництві вибухових речовин (див. ацетиленіди ),
- для отримання оцтової кислоти , етилового спирту , розчинників , пластичних мас , каучуку , ароматичних вуглеводнів .
- для отримання технічного вуглецю
- в атомно-абсорбційної спектрофотометрії при полум'яної атомізації
- в ракетних двигунах (разом з аміаком ) [10]
Оскільки ацетилен розчиняється в воді, і його суміші з киснем можуть вибухати в дуже широкому діапазоні концентрацій, його не можна збирати в газометри .
Ацетилен вибухає при температурі близько 500 ° C або тиску вище 0,2 МПа; КПВ 2,3-80,7%, температура самозаймання 335 ° C. Вибухонебезпечність зменшується при розведенні ацетилену іншими газами, наприклад азотом , метаном або пропаном .
При тривалому зіткненні ацетилену з міддю і сріблом утворюються ацетиленіди міді і срібла, які вибухають при ударі або підвищенні температури. Тому при зберіганні ацетилену не використовуються матеріали, що містять мідь (наприклад, вентилі балонів).
Ацетилен має незначний токсичною дією. Для ацетилену нормований ПДКм.р. = ГДК с.с. = 1,5 мг / м³ згідно гігієнічним нормативам ГН 2.1.6.1338-03 «Гранично допустимі концентрації (ГДК) забруднюючих речовин в атмосферному повітрі населених місць».
ПДКр.з. (Робочої зони) не встановлено (по ГОСТ 5457-75 і ГН 2.2.5.1314-03), так як концентраційні межі розподілу полум'я в суміші з повітрям становить 2,5-100%.
Зберігають і перевозять його в заповнених інертною пористою масою (наприклад, деревним вугіллям ) Сталевих балонах білого кольору (з червоним написом «А») у вигляді розчину в ацетоні під тиском 1,5-2,5 МПа.
- ↑ ГОСТ 5457-75. Ацетилен розчинений і газоподібний технічний. Технічні умови
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0008.html
- ↑ Відео даного процесу
- ↑ 1 2 Хвостов, 1988 .
- ↑ Лапідус А. Л., Голубєва І. А., Жагфаров Ф. Г. газохімії. Навчальний посібник. - М.: ЦентрЛитНефтеГаз, 2008. - 450 с. - ISBN 978-5-902665-31-1 .
- ↑ Велика енциклопедія нафти і газу. Неприємний запах - ацетилен (неопр.). Дата обігу 10 жовтня 2013.
- ↑ Корольченко. Вогнестійкість, 2004 , С. 198.
- ↑ Міллер. Ацетилен, його властивості, отримання та застосування, 1969 , С. 72.
- ↑ ацетилен (неопр.) (Недоступна посилання). Дата обігу 10 жовтня 2013. Читальний зал 1 жовтня 2013 року.
- ↑ У Росії розробили ракетний двигун на аміаку - Известия
- Міллер С. А. Ацетилен, його властивості, отримання та застосування. - Л.: Хімія, 1969. - Т. 1. - 680 с.
- Корольченко А. Я., Корольченко Д. А. вогнестійкість і засоби їх гасіння. Довідник: в 2-х частинах. Частина 1. - М.: Асоціація «Пожнаука», 2004. - 713 с. - ISBN 5-901283-02-3 .
- Хвостов І. В. Ацетилен // Хімічна енциклопедія: у 5 т / Кнунянц І. Л. (Гл. Ред.). - М.: Радянська енциклопедія , 1988. - Т. 1: А-Дарзана. - С. 226-228. - 623 с. - 100 000 прим. - ISBN 5-85270-008-8 .