А важкі сп е ктри, спектри оптичні , Що виходять при випущенні або поглащении світла (електромагнітних хвиль) вільними або слабо пов'язаними атомами; такими спектрами мають, зокрема, одноатомні гази і пари. А. с. є лінійчатими - вони складаються з окремих спектральних ліній. А. с. спостерігаються у вигляді яскравих кольорових ліній при світінні газів або парів в електричній дузі або розряді (спектри випускання) і у вигляді темних ліній (спектрів поглинання). Кожна спектральна лінія характеризується певною частотою коливань v випускається або поглинається світла і відповідає певному квантовому переходу між рівнями енергії E i і E k атома згідно співвідношенню: hv = E i - E k, де h - планка постійна ). Поряд з частотою спектральну лінію можна характеризувати довжиною хвилі l = c / v, хвильовим числом 1 / l = v / c (c - швидкість світла) і енергією фотона hv.
А. с. виникають при переходах між рівнями енергії зовнішніх електронів атома і спостерігаються в видимій, ультрафіолетовій і близькій інфрачервоній областях. Такими спектрами мають як нейтральні, так і іонізованниє атоми; їх часто називають відповідно дуговими і іскровими спектрами (нейтральні атоми легко збуджуються і дають спектри випускання в електричних дугах, а позитивні іони порушуються важче і дають спектри випускання переважно в іскрових електричних розрядах). Спектри іонізованих атомів зміщені по відношенню до спектрами нейтральних атомів в область високих частот, т. Е. В ультрафіолетову область. Цей зсув тим більше, чим вище кратність іонізації атома - чим більше електронів він втратив. Спектри нейтрального атома і його послідовних іонів позначають в спектроскопії цифрами I, II, III, ... В реально спостережуваних спектрах часто присутні одночасно лінії нейтрального та іонізованих атомів; так кажуть, наприклад, про лінії FeI, FeII, FeIII в спектрі заліза, відповідних Fe, Fe +, Fe2 +.
Лінії А. с. утворюють закономірні групи, називаються спектральними серіями. Проміжки між лініями в серії зменшуються в бік коротких довжин хвиль, і лінії сходяться до кордону серії. Найбільш простий спектр атома водню. Хвильові числа ліній його спектра з величезною точністю визначаються формулою Бальмера:
1 / l = R (1 / n2 1 - 1 / n22),
де n 1 і n 2 значення головного квантового числа для рівнів енергії, між якими відбувається квантовий перехід (див. атом , Рис. 1, б). Значення n 1 = 1, 2, 3, ... визначає серію, а значення n 2 = n 1 + 1, n1 + 2, n1 + 3 ... визначає окремі лінії даної серії; R - Рідбергу постійна (Виражена в хвильових числах). При n 1 = 1 виходить серія Лаймана, що лежить в далекій ультрафіолетової області спектра, при n 1 = 2 - серія Бальмера, лінії якої розташовані у видимій і близькій ультрафіолетовій областях. Серії Пашена (n 1 = 3), брекетах (n 1 = 4), Пфаунда (n 1 = 5), Хамфрі (n 1 = 6) лежать в інфрачервоній області спектра. Аналогічними спектрами, тільки зі збільшеним в Z2 раз масштабом (Z - атомний номер), мають водородоподобном іони Чи не +, Li2 +, ... (CПЕКТР HeII, LiIII, ...).
Спектри атомів лужних металів, що володіють одним зовнішнім (оптичним) електроном крім заповнених оболонок, схожі зі спектром атома водню, але зміщені в область менших частот; число спектральних серій збільшується, а закономірності в розташуванні ліній ускладнюються. Приклад - спектр Na, атом якого має нормальної електронною конфігурацією 1 s 22 s 2 + 2 p 63 s (див. В ст. атом - Заповнення електронних оболонок і шарів) з легко порушуються зовнішнім електроном 3 s; переходу цього електрона зі стану 3 s в стан 3 p відповідає жовта лінія Na (дублет l = 5690 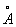 і l = 5696
і l = 5696 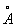 ; см. рис.), з якої починається т. зв. головна серія Na, члени якої відповідають переходам між станом 3 s і станами 3 p, 4 p, 5 p, ... межа серії відповідає іонізації атома Na.
; см. рис.), з якої починається т. зв. головна серія Na, члени якої відповідають переходам між станом 3 s і станами 3 p, 4 p, 5 p, ... межа серії відповідає іонізації атома Na.
Для атомів з двома або кількома зовнішніми електронами спектри значно ускладнюються, що обумовлено взаємодією електронів. А. с. особливо складні для атомів з заповнювати d- і f-оболонках; число ліній доходить до багатьох тисяч, і вже не можна виявити простих серій, аналогічних серіям в спектрах водню і лужних металів. Однак і в складних спектрах можна встановити певні закономірності в розташуванні ліній, провести систематику спектра і визначити схему рівнів енергії.
Систематика спектрів атомів з двома або більше зовнішніми електронами заснована на наближеною характеристиці окремих електронів за допомогою квантових чисел n і l (див. атом ) З урахуванням взаємодії цих електронів один з одним. При цьому доводиться враховувати електростатичні взаємодії електронів - відштовхування за законом Кулона, і магнітні взаємодії спінових і орбітальних моментів (див. спін , Спін-орбітальна взаємодія ), Які призводять до тонкого розщеплювання рівнів енергії (див. тонка структура ). Завдяки цьому у більшості атомів спектральні лінії являють собою більш-менш тісну групу ліній, звану мультиплеті. Так, у всіх лужних металів лінії подвійні (дублети), причому відстані між Мультиплетність рівнями збільшуються зі збільшенням атомного номера елемента. У лужноземельних елементів спостерігаються поодинокі лінії (сінгулети) і потрійні (триплети). Спектри наступних стовпців таблиці Менделєєва утворюють все більш складні мультіплети, причому непарним стовпчиках відповідають парні мультіплети, а парних стовпцями - непарні.
Крім тонкої структури, в А. с. спостерігається надтонка структура , Обумовлена магнітними моментами ядер. Надтонка структура по порядку величини в 1000 разів вже звичайною мультиплетной структури і досліджується методами радиоспектроскопии .
В А. с. проявляються не всі переходи між рівнями енергії даного атома або іона, а лише цілком певні, що допускаються (дозволені) т. н. відбору правилами , Залежними від характеристик рівнів енергії. У разі одного зовнішнього електрона можливі лише переходи, для яких азимутальное квантове число l збільшується або зменшується на 1; правило відбору має вигляд: D l = ± 1. В результаті s-yровня (l = 0) комбінують з р-рівня (l = 1), р-рівня - з d -yровнямі (l = 2) і т. Д., Що визначає можливі спектральні серії для атомів лужних металів, окремий випадок яких представляє головна серія Na (переходи 3 s ® np, де n = 3, 4, 5, ...); інші переходи цим правилом відбору заборонені. Для багатоелектронних атомів правила відбору мають більш складний вид.
Кількісною характеристикою дозволеного оптичного переходу є його ймовірність (див. імовірність переходу ), Яка визначає, як часто цей перехід може відбуватися; ймовірність заборонених переходів дорівнює нулю. Від ймовірностей переходів залежать інтенсивності спектральних ліній. У найпростіших випадках ймовірності переходів для А. с. можуть бути розраховані за методами квантової механіки .
Поряд з вивченням А. с. для вільних атомів значний інтерес представляє дослідження змін в А. с. при зовнішніх впливах на атоми. Під дією зовнішнього магнітного або електричного поля відбувається розщеплення рівнів енергії атома і відповідне розщеплення спектральних ліній (див. Зеемана явище і Штарка явище ).
Дослідження А. с. зіграло важливу роль в розвитку уявлень про будову атома (див. атомна фізика ). Методи, засновані на вивченні А. с., Дуже широко поширені в різних областях науки і техніки. А. с. дозволяють визначити ряд дуже важливих характеристик атомів і отримати цінні відомості про будову електронних оболонок атома. Надзвичайно істотно застосування А. с. в емісійному спектральному аналізі (По А. с. Випускання), який завдяки високій чутливості, швидкості і універсальності завоював міцне місце в металургії, гірничорудної промисловості, машинобудуванні та в багатьох інших галузях народного господарства; поряд з емісійним спектральним аналізом успішно застосовують і абсорбції спектральний аналіз (по А. с. поглинання).
Літ .: Шпольський Е. В., Атомна фізика, 5 видавництво., Т. 1, М., 1963, т. 2, М., 1951: Фріш С. Е., Оптичні спектри атомів, М.-Л., 1963; Ельяшевич М. А., Атомна і молекулярна спектроскопія, М., 1962.
М. А. Ельяшевич.

Жовта лінія в спектрі атома Na (дублет l = 5690 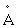 і l = 5696).
і l = 5696).